Diffusion und Osmose
Lebende Zellen stehen ständig im Austausch mit ihrer Umgebung. Stoffe müssen aufgenommen, verteilt und wieder abgegeben werden. Viele dieser Transportvorgänge laufen ohne Energieaufwand ab und beruhen auf physikalischen Prozessen. Zwei der wichtigsten Grundlagen dafür sind die Diffusion und die Osmose. Unter Diffusion versteht man die gleichmäßige Verteilung von Teilchen in zwei unterschiedlich konzentrierten Systemen durch ihre zufällige Eigenbewegung. Beispiele sind der Austausch von Sauerstoff und Kohlenstoffdioxid in den Lungenbläschen oder die Verteilung von Nährstoffen und Ionen im Cytoplasma.
Die Osmose stellt ein Spezialfall der Diffusion dar, bei dem Wasser durch eine semipermeable Membran diffundiert. Semipermeabel bedeutet „halbdurchlässig“: Eine solche Membran lässt zum Beispiel Wasser, aber nicht alle darin gelösten Stoffe hindurch. Befinden sich auf beiden Seiten einer solchen Membran unterschiedlich konzentrierte Lösungen, so wandert Wasser aus der verdünnten Lösung zum Ort der Lösung mit höherer Konzentration. Das System gleicht die Konzentrationsunterschiede aus. Der Wassertransport durch die Membran erzeugt eine Druckdifferenz, den sogenannten osmotischen Druck. Er ist ein Maß dafür, wie stark Wasser in die konzentriertere Lösung hineinströmen möchte. Je höher der Konzentrationsunterschied der beiden gelösten Stoffe ist, desto größer ist der osmotische Druck.
In Pflanzenzellen ist dieser Druck lebenswichtig: Durch den osmotisch verursachten Wasserstrom füllt sich die Zelle mit Wasser, die Zellmembran drückt von innen gegen die Zellwand, und es entsteht der innere Druck, der Turgor genannt wird. Dieser verleiht den Pflanzen ihre Festigkeit und ihre aufrechte Haltung. Bei den Pflanzen sorgt die Osmose für die Aufnahme von Wasser in die Wurzelzellen. Dort ist die Konzentration der gelösten Stoffe höher als im Boden. Dies erzeugt einen osmotischen Druck, weshalb Wasser in die Wurzelzellen strömt. Der osmotische Druck hält den Wasserstrom zu den Leitbündeln (Xylem) am Leben, wo der Weitertransport durch den Unterdruck erfolgt, der bei der Transpiration in den Blättern entsteht. Der Zusammenhalt der Wassermoleküle untereinander wird durch die Wasserstoffbrückenbindungen gefestigt, so dass die Wassersäule niemals abbricht.
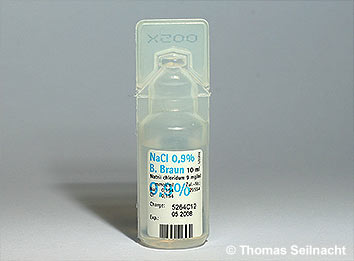
Für tierische Zellen kann zu viel oder zu wenig Wasser gefährlich sein, da ihnen eine feste Zellwand fehlt. Wenn eine tierische Zelle in eine stark verdünnte Lösung (hypotonisch) gelangt, kann sie platzen. In einer konzentrierteren Lösung (hypertonisch) verliert sie Wasser und schrumpft. Ist die Konzentration in der Zelle und in der Lösung gleich, dann liegt eine isotonische Lösung vor. Deshalb kann eine isotonische, 0,9%ige Kochsalzlösung bei Infusionen eingesetzt werden.
Bei dem klassischen Schulversuch zur Diffusion wird mit einer feinen Pinzette ein Kriställchen Kaliumpermanganat auf den Boden eines mit Wasser gefüllten Standzylinders gelegt. Das Wasser soll dabei nicht bewegt werden. Die Färbung des Wassers wird über längere Zeit 10 bis 20 Minuten lang beobachtet. Nach kurzer Zeit färbt sich das Wasser rund um das Kristall violett. Die Farbe breitet sich allmählich nach allen Seiten aus, bis das Wasser gleichmäßig gefärbt ist. Man kann sich das Phänomen so erklären, dass sich die Teilchen in der Flüssigkeiten in ständiger, ungeordneter Bewegung befinden. Diese Eigenbewegung führt nach und nach zur Verteilung im gesamten Standzylinder. Allerdings spielen bei diesem Versuch auch andere physikalische Phänomen eine Rolle, zum Beispiel Dichteunterschiede und thermisch verursachte Strömungen.
Ein einfacher Versuch, den man in jeder Küche durchführen kann, verdeutlicht die Wirkung der Osmose: Zwei Radieschen werden oben mehrfach eingeschnitten. Das eine Radieschen wird in destilliertes Wasser gelegt, das andere in konzentriertes Salzwasser. Nach mehreren Stunden vergleicht man die beiden Radieschen: Das Radieschen im Salzwasser fühlt sich sehr weich an, und es wirkt etwas verschrumpelt. Das Radieschen im destillierten Wasser fühlt sich hart und „knackig“ an, es hat sich an den Schnittflächen rosettenartig aufgespreizt. Wie lassen sich diese Phänomene erklären?